วันอังคารที่ 25 สิงหาคม พ.ศ. 2558
บทที่ 1 อะตอมและตารางธาตุ
แบบจำลองอะตอม ตามทฤษฏี มีอยู่ 5 แบบ คือ
1. แบบจำลองอะตอมของดอลตัน
2. แบบจำลองอะตอมของทอมสัน
- ค้นพบอิเล็กตรอน ที่ มีประจุไฟฟ้าลบ มีมวลประมาณ1/2000 ของมวลของ H
- โดยศึกษาพฤติกรรมของ หลอดรังสีแคโทด ในสนามแม่เหล็กไฟฟ้า
3. แบบจำลองของรัทเทอร์ฟอร์ด
รัทเทอร์ฟอร์ดพบว่ารังสีส่วนใหญ่ไม่เบี่ยงเบน
และส่วนน้อยที่เบี่ยงเบนนั้น ทำมุมเบี่ยงเบนใหญ่มาก
บางส่วนยังเบี่ยงเบนกลับทิศทางเดิมด้วย
จำนวนรังสีที่เบี่ยงเบนจะมากขึ้นถ้าความหนาแน่นของแผ่นโลหะเพิ่มขึ้นอ่านเพิ่มเติม
บทที่ 2 พันธะเคมี
พันธะเคมี
ชนิดของพันธะเคมี
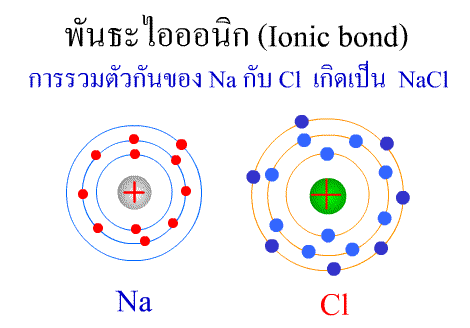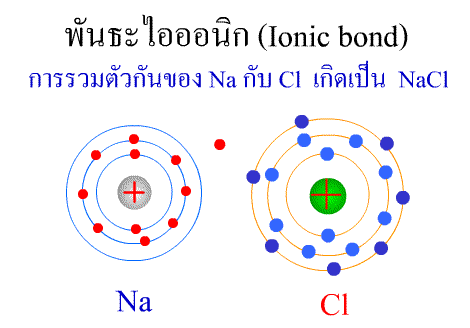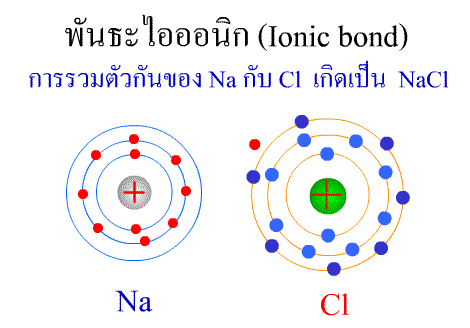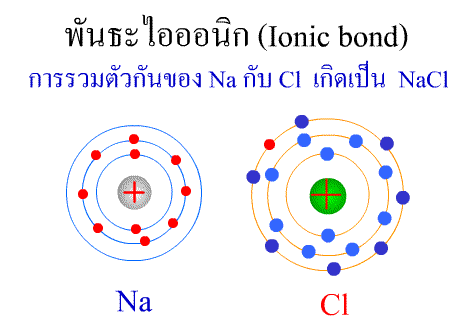
พันธะไอออนิก ( Ionic
bond ) หมายถึง
แรงยึดเหนี่ยวที่เกิดในสารประกอบที่เกิดขึ้นระหว่าง 2
อะตอมอะตอมที่มีค่าอิเล็กโตรเนกาติวิตีต่างกันมาก อะตอมที่มีค่าENน้อยจะให้ e แก่อะตอมที่มีค่า ENมาก และทำให้ e ที่อยู่รอบๆ อะตอมครบ 8
กลายเป็นไอออนบวก และไอออนลบตามลำดับ เกิดแรงดึงดูดทางไฟฟ้าระหว่างไอออนบวกและไอออนลบ
และเกิดเป็นโมเลกุลขึ้น เช่น การเกิดสารประกอบ NaCl ดังภาพ
บทที 3 สมบัติของธาตุและสารประกอบ
สมบัติของธาตุและสารประกอบ
สมบัติของสารประกอบของธาตุตามคาบ
จากการศึกษาสมบัติต่างๆ ของธาตุในตารางธาตุ เช่น ขนาดอะตอม
พลังงานไอออไนเซชัน และค่าอิเล็กโทรเนกาติวิตี
จะพบว่าสมบัติเหล่านี้มีแนวโน้มการเปลี่ยนแปลงจากซ้ายไปขวาในแต่ละคาบ
หรือจากบนลงล่างในแต่ละหมู่ค่อนข้างสม่ำเสมอ
ต่อไปจะศึกษาสมบัติของสารประกอบของธาตุตามคาบว่ามีแนวโน้มเป็นอย่างไร
โดยการศึกษาจุดหลอมเหลว จุดเดือดและความเป็นกรด -
เบสของสารประกอบคลอไรด์และออกไซด์ของธาตุในคาบที่ 2 และ 3 จากข้อมูลในตางราง อ่านเพิ่มเติม
สมัครสมาชิก:
ความคิดเห็น (Atom)